Mikrobiológia: Jegyzet
Biotechnológia
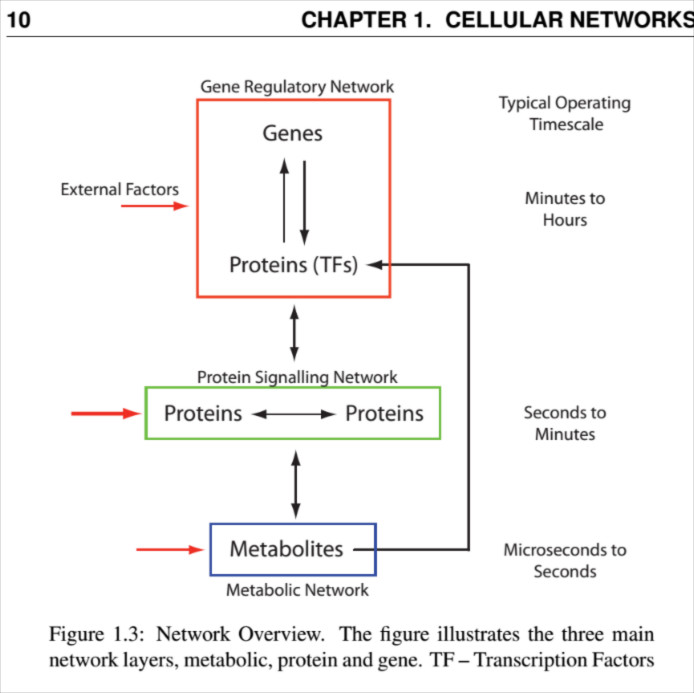
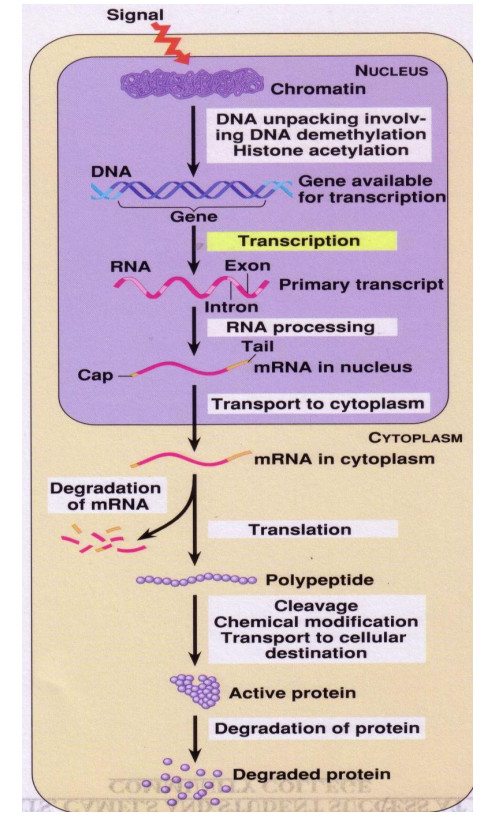
Géntechnológia és fehérjemérnökség
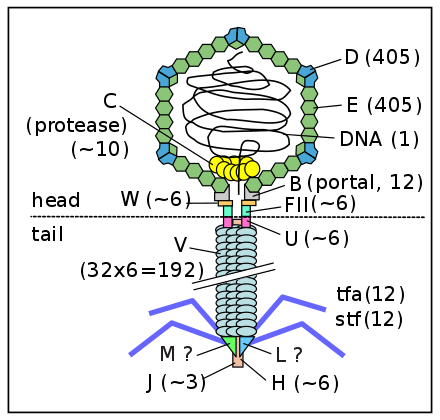

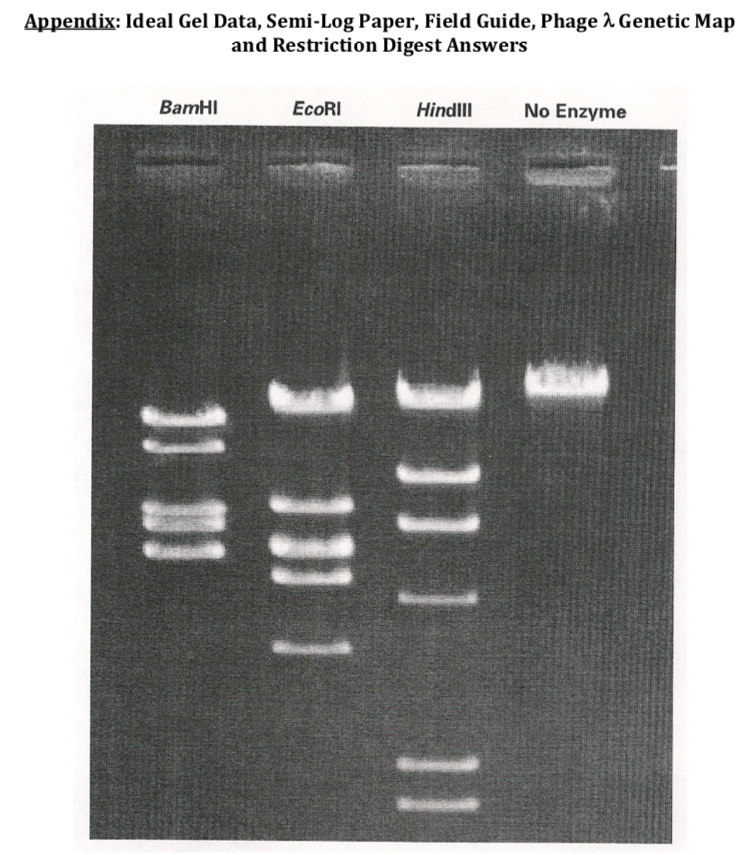
Phage Lambda DNA / Hind iii digest ready-to-use
Feladat otthonra: Állapítsátok meg milyen szekvenciák keletkeznek Lambda fág ECORI és HINDIII-mal történő hasítása esetén
Lambda phage szekvenciája: https://www.snapgene.com/plasmids/basic_cloning_vectors/lambda
Restrikciós emésztés szimulátor: https://nc3.neb.com/NEBcutter/
Házi feladat: Csináljuk meg a következő gyakorlatot.
Házi feladat: tervezz
primereket a 3. pontban izolált plazmidhoz!
PCR
25 ul Master Mix (green)
5 ul Forward primer (10x higított!)
5 ul Revers primer (10x higított)
5 ul DNS
Kiegészítve 50 ul-re d.v.-el
Typical Cycling Parameters
25-30 cycles of amplification are recommended.
PCR Step Temperature °C Duration
Denature template
94 °C
1 min
Anneal primers
55 °C
2 min
Extension
72 °C
3 min
5) Táptalaj készítése
Jegyzetből
Tápagar: húskivonat 3,0 g
pepton 10,0 g
agar-agar 20,0 g
desztillált víz 1000,0 ml
pH: 7,2 Sterilizálás 120 °C-on 20 percig.
6) Mikroorganizmusok izolálása környezetből
1. Baktériumok izolálása, különböző felületek mikróba szennyezettségének vizsgálata
Környezetünkben mindenütt megtalálhatók a baktériumok és spórái.
Anyagok: 2 petri-csésze tápagar
2 petri-csésze véres agar
Eljárás:
1. Vegyük le az egyik steril petri-csésze fedelét 15 percre, a másikban lévő agar felületén húzzuk végig az ujjunkat.
2. Köhögjünk rá az egyik véres agarra kb. 30 cm-ről, steril vattával töröljünk át poros felületet és érintsük meg vele a másik véres-agar felületét.
3. Inkubáljuk valamennyi Petri-csészét 24 óráig 37 °C-on.
Vizsgáljuk meg a lemezeket, írjuk le észrevételeinket.
7) Festés
Jegyzetből:Az élő tenyészetek vizsgálhatók festetlenül és natív festéssel.
Egyszerű festetlen preparátum készítése:
Anyagok:
Bacillus subtilis 24 órás tenyészete tápagaron
Escherichia coli 24 órás tenyészete tápagaron
Micrococcus luteus 24 órás tenyészete tápagaron
Pseudomonas aeruginosa 24 órás tenyészete tápagaron
tárgylemezek, fedőlemezek, oltókacs.
Különböző felületekről szaporított baktériumok.
Eljárás:
1. Cseppentsünk 1 csepp deszt. vizet a tárgylemezre.
2. Oltótűvel vegyünk ki a baktériumtenyészetből parányi mennyiséget és szuszpendáljuk a vízcseppbe.
3. Fedjük le a preparátumot.
4. Mikroszkóp alatt vizsgáljuk meg a baktériumokat.
Eredmény: A láthatóság az egyszerű vizsgálatnál csekély.
Vizsgálat natív festéssel
Anyagok:
Bacillus subtilis 24 órás tenyészete tápagaron
Escherichia coli 24 órás tenyészete tápagaron
Micrococcus luteus 24 órás tenyészete tápagaron
Pseudomonas aeruginosa 24 órás tenyészete tápagaron
kristályibolya festékoldat (0,05%)
metilénkék festékoldat (0,02%)
tárgylemezek, fedőlemezek, oltókacs.
Eljárás:
1. Cseppentsünk egy csepp kristályibolya festéket a tárgylemezre.
2. Oltókaccsal vegyünk ki a baktériumtenyészetekből parányi mennyiséget és szuszpendáljuk el a tárgylemezen levő folyadékcseppben.
3. Fedjük le a preparátumot és 5 perc eltelte után mikroszkópban vizsgáljuk meg.
4. Figyeljük meg a baktérium alakját.
5. Ismételjük meg az eljárást egy másik baktériummal és a metilénkék festékoldattal.
Eredmény: A kristályibolyával festett baktériumok sötétkék, a metilénkékkel festettek világoskék színűek. A festék ebben a koncentrációban még nem öli meg a baktériumokat
(3. ábra).
Figyeld meg a baktériumok alakját és mozgásukat! Jegyezd le melyek mozognak, és milyen intenzitással!